2013年肾脏病学研究进展回顾(二)
发布时间:[2014.02.24] 点击:456次
急性肾损伤
概念更新:从急性肾损伤(AKI)至肾脏病发作(kidneyattack)
尽管2012年的改善全球肾脏病预后组织(KDIGO)指南对AKI的定义有了最新诠释,但长期以来,人们对于AKI的定义仍难达成共识。
与之类似的是,急性冠脉综合征(ACS)也是历经数年才有了如今的诊断标准和分类。ACS是基于症状(胸痛发作)、心电图(ECG)异常(ST段抬高心梗和非ST段抬高心梗)以及生物标志物(肌钙蛋白)来定义的。
过去,我们曾用急性肾小管坏死(ATN)、急性肾功能衰竭(ARF)、急性肾脏病(AKD)或急性肾损伤(AKI)来定义急性肾脏疾病,但最近,人们已将急性肾脏疾病系列综合征统称为“kidney attack”,即肾脏病发作。
肾脏病发作的准确定义应该包括单纯肾脏缺血(中毒、过敏、代谢、梗阻以及脓毒症)、急性肾脏结构或功能异常。因此,随着人们对AKI知晓率和警惕性的提高,肾脏病发作这个概念的提出,将与心脏病发作(heartattack)的概念一样,更有助于提高人们对危重肾脏病的认识。
与心脏病发作不同,肾脏的“沉默寡言”使得即使肾脏病发作病情严重,临床上也可能无任何表现。尽管如此,一旦肾脏病发作,其对患者的短期、长期以及肾功能预后仍有深远影响。
AKI的KDIGO定义,主要依赖血清肌酐或尿量标准。然而尿量以及肌酐标准本身的缺陷使得目前的AKI定义标准无法诊断所有的肾脏病发作以及区分其严重程度。
人们用肾绞痛(renal angina,RA)来定义血清肌酐升高小于0.3mg/dl的肾脏病。肾绞痛具有发生AKI的风险,另外,与正常人群相比,此类患者的患病率和病死率显著增加。
因此,最新发表的有关肾脏病发作以及相关临床症候群的图谱将有助于早期诊断,并有助于与心脏病发作相比较,例如,肌酐升高AKI(CRIAKI或功能异常AKI)对应ST段抬高心梗,非肌酐升高AKI(NCRIAKI或亚临床AKI)对应非ST段抬高心梗,肾绞痛则介于亚临床AKI与临床AKI之间,类似于不稳定型心绞痛发作。
AKI的生物标志物研究进展
生物标志物的预测效果研究
在第十届急性透析质量倡议(ADQI)国际会议上公布的AKI新型生物标志物有胰岛素样生长因子结合蛋白-7(IGFBP-7)和组织基质金属蛋白抑制剂-2(TIMP-2),二者均在AKI发生前36h表达升高。尿中此二者浓度升高至某个阈值,临床医师可借此预测AKI的发生风险。
前期大量研究数据证实,早期AKI的生物标志物包括中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、肾脏损伤分子-1(KIM-1)、L型脂肪酸结合蛋白(L-FABP)、α谷胱甘肽S转移酶(α-GST)和白介素-18(IL-18),这些标志物均在血清肌酐升高前24~48h升高。因此,这些标志物的检测有助于亚临床AKI的判断,并对患者的预后判断有重要意义。
近期研究表明,IL-18、NGAL和KIM-1是预测脓毒症AKI相对强烈的信号分子。对于多数肾脏损伤而言,尿中生物标志物浓度和比例的增加均要较其在血浆中的水平明显,例如,尿中胱抑素C(Cystatin C)和白蛋白升高,则预示近端小管重吸收功能障碍。近两年来,人们逐渐开始关注循环中的miRNA作为AKI生物标志物。
2011年,洛伦岑(Lorenzen JM)等发现,与正常对照相比,77例AKI患者中的miR-210水平显著升高,且其血清水平升高可以预测患者进行肾脏替代治疗4周后的死亡率。还有观察显示,血清中的10个miRNA,包括miR-101-1、miR-127-3p、miR-210、miR-126、miR-26b、miR-29a、miR-146a、miR-27a、miR-93和miR-10a,均可以作为AKI的生物标志物,而且其诊断AKI的敏感性和特异性均接近100%。
甚至还有研究显示,AKI患者血清中的miRNA水平升高要早于血清肌酐,因此可作为早期诊断生物标志物。此外,这些生物标志物还有利于危重肾脏病患者进行AKI的鉴别诊断和预后判断。
无论患者是否接受肾脏替代治疗,生物标志物对AKI患者的死亡均有预测作用。近期研究表明,尿中NGAL水平可用于独立预测AKI的恢复可能性,其曲线下面积(AUC)=0.78。
多种生物标志物联合预测效果更佳
通常,单纯一种生物标志物水平升高越多,且与其他多种生物标志物水平升高的一致性越强,并伴有肾小球滤过率以及尿量减少时,人们可认为该生物标志物与AKI严重程度和临床预后相关性越强。
但仅靠单一的、具有足够敏感性和特异性的标志物也并不能反映AKI病理生理和病情变化的全过程。例如,人们已开始联合NGAL与脑钠肽(BNP)、肌钙蛋白、Cystatin C等用于评估心肾综合征患者,且研究结果表明,BNP和NGAL均升高患者预后最差。最新的两项大型研究表明,危重患者的多种生物标志物有助于准确预测其预后。
第一项前瞻观察性研究纳入2个普通重症监护病房(ICU)中的529例患者,所观察的生物标志物包括尿γ谷氨酰转肽酶(γ-GT)、碱性磷酸酶、NGAL、Cystatin C、KIM-1和IL-18,结果显示,入住ICU时,所有AUC值超过0.7的生物标志物均可诊断或预测AKI的发生;而NGAL、Cystatin C和IL-18可预测是否需要肾脏替代治疗;所有标志物(KIM-1除外)均可以预测7天死亡率(AUC介于0.61~0.69)。
第二项前瞻性研究纳入内科-外科ICU中339例成人患者,其中有131例发生AKI(根据RIFLE标准),该研究显示,尿中标志物肝型脂肪酸结合蛋白(L-FABP)的AUC值为0.75;尿中NGAL、Cystatin C和IL-18可以预测患者14天死亡率,其AUC值介于0.83(IL-18的AUC值)和0.89(L-FABP的AUC值);值得注意的是,联合NGAL、Cystatin C和IL-18三种生物标志物可以提高14天死亡率预测性(AUC为0.93)。
因此,合理、有效的AKI生物标志物组合方式研究,将促进AKI早期诊断、病情监测和治疗的进步。
AKI与容量负荷
①肾脏间质水肿和肾小管受压使肾脏血流量减少,肾小球滤过率下降;
②容量超负荷继发腹腔内脏水肿,导致腹腔内高压和腹腔间隔综合征,使肾静脉受压,肾脏血流减少;
③容量超负荷易合并高氯血症,也可影响肾脏血流量,减少钠排泄;
④容量超负荷时大量使用利尿剂,可加重肾功能恶化;
⑤严重容量超负荷(尤其是晶体溶液补充过多)时,血浆胶体渗透压降低,液体向细胞外第三间隙转移(在毛细血管通透性增加时尤为明显),导致有效循环血容量减少、血管再充盈率降低,加重血流动力学紊乱,进一步加重肾功能损害。
液体治疗是恢复器官灌注、改善心输出量重要手段,但临床实践表明,肺部感染并发急性呼吸窘迫综合征(ARDS)、重大手术发生AKI时,液体治疗并不能预防AKI,相反,过量的输液引起液体超负荷会成为影响预后的重要因素(其机制见下表)。

容量超负荷是危重患者预后不佳的标志。在危重患者脓毒症事件研究中,共纳入24个欧洲国家198个ICU,观察了1177例脓毒症和197例非脓毒症患者在入ICU后72h的液体平衡情况,期间脓毒症组与非脓毒症组液体正平衡分别为+1.8L和+0.5L,多元回归分析显示,液体增加1L,则死亡风险增加10%,液体正平衡是预后不佳的独立危险因素。
向(Heung)等进行的一项单中心回顾性研究发现,在170例由急性肾小管坏死继发AKI的患者中,经肾脏替代治疗1年后,仅35.9%的患者肾功能恢复,1年死亡率为29.5%,肾功能未恢复组死亡率高达85.3%。
肾功能恢复组在开始肾脏替代治疗时容量超负荷的情况显著低于肾功能未恢复组(3.5%对9.3%,P=0.004);多变量比例风险回归分析显示,开始肾脏替代治疗时,容量超负荷比例越高者的肾功能不恢复的可能性越大(P=0.024)。这表明,容量超负荷是提示肾功能不恢复和死亡的危险因素。
AKI与血液净化治疗
目前有关AKI肾脏替代血液净化治疗模式、治疗剂量和时机仍未有定论,其原因在于AKI危重症患者并不能从任何一种肾脏替代治疗模式或剂量中获得最大生存率。肾脏替代治疗模式的选择应该取决于患者的临床状态、专家经验和临床资源。
延长间断肾脏替代治疗模式,即连续缓慢低效透析(SLED)是杂合式肾脏替代治疗模式。SLED拥有传统间歇式血液透析(IHD)以及连续性肾脏替代治疗(CRRT)的优点,且因为可以使用枸橼酸而适用于具有严重出血风险的患者。但SLED在心源性休克、暴发性肝衰、高颅内压以及药物代谢方面缺乏相应的临床实践证据,因此SLED若想得到人们的广泛接受仍有待时日。、
急性肾损伤(AKI)与腹膜透析
腹膜透析常用于治疗AKI,这在资源缺乏的情况下更为常见。但腹膜透析治疗AKI的效果尚不确定,为此,意大利维琴察医院的基翁(Chionh)等对腹膜透析治疗AKI进行了系统评价,以比较腹膜透析和体外血液净化治疗AKI的预后。
Chionh等检索了MEDLINE、CINAHL和对照试验注册中心数据库1966年至2012年7月有关腹膜透析治疗AKI的研究,主要的预后指标是全因死亡率。从初检的982项研究中检出24项符合条件的研究,患者总数为1556例,大部分研究(9/24)来自资源较为匮乏的地区。
其中,13项研究共579例AKI患者均接受腹膜透析治疗,死亡率为39.3%;其余11项研究中有7项队列研究和4项随机对照试验,392例患者接受腹膜透析治疗(死亡率58%),567例接受体外血液净化治疗(死亡率56.1%)。
以上结果提示:①腹膜透析治疗AKI缺乏高质量的临床研究数据,仅有4项小型随机对照试验;②11项对照研究的总体死亡率比较结果提示,腹膜透析与体外血液净化治疗AKI患者的死亡率差异无统计学意义;③多数研究缺乏腹膜透析剂量、肾功能恢复和腹膜透析相关并发症等重要数据。此外,有部分研究比较了两种治疗方式的肾功能恢复时间,结果表明,血流动力学较稳定的腹膜透析治疗并未表现出预期优势。
由上可知,腹膜透析和体外血液净化治疗AKI的患者死亡率无差异,提示腹膜透析也可以作为AKI治疗的一项选择。一方面可以根据患者的临床情况以及透析中心的人力和设备资源选择合适的治疗方案,另一方面仍需要设计大样本随机对照试验对比两种治疗方式的临床预后和治疗费用,从而为将来AKI治疗方案的选择提供循证医学证据。
AKI的基础研究进展
干细胞与AKI
目前尚无有效药物治疗AKI,无法对损伤的细胞进行更新或替代,导致发生AKI的肾脏小管间质纤维化或瘢痕形成,最终使肾脏走向慢性肾脏病。而干细胞具有多向分化潜能,且对AKI的缺血再灌注损伤有疗效。
近期,有学者采用骨髓来源的间充质干细胞(BM-MSC)治疗肾脏缺血再灌注损伤小鼠模型,结果表明,MSC治疗组不论在组织形态学还是在血清学方面均表现出肾脏保护作用。因此该研究提示,MSC有望成为未来临床治疗AKI的要手段。
免疫反应与AKI
目前人们对全身炎症反应在AKI发病机制中所起作用的认识已较为深入,却对AKI的免疫反应知之甚少。不论是动物还是人体研究数据均表明,AKI发病与炎症反应和免疫抑制效应均密切相关。肾脏的缺血再灌注损伤同样会干扰全身炎症反应的结果。
已有研究显示,肾脏缺血再灌注损伤后会出现淋巴细胞长时间的激活效应。而肾移植后的移植肾失功发生率增高与持续的亚临床免疫活化密切相关,且基础研究已证实,失功肾脏的T淋巴细胞、选择素、整合素以及趋化因子受体-2或7等均有活化。
由此人们推测,移植肾发生缺血再灌注损伤可能经历一系列病理生理过程,并最终导致抗体介导的排斥反应。有学者已在动物研究中证实,肾脏缺血再灌注损伤可导致相应抗体产生,这些抗体可能对移植肾造成损害,最终可以解释缺血再灌注损伤为何会造成移植肾功能恢复延迟或长期的移植肾失功。
由此,若针对缺血再灌注损伤体液免疫中的某个环节进行靶向治疗,则有望成为治疗移植肾功能恢复延迟的重要手段。
血液净化治疗
血液透析(HD)
血液透析滤过
HD治疗方式的争议在于弥散还是对流,即增加对中大分子毒素的清除是否能获益。在线血液透析滤过(OL-HDF)是目前清除毒素最有效的方式,但是否改善患者预后、降低心血管并发症目前并不清楚。
一项以荷兰透析中心为主的多中心随机对照研究(RCT),纳入714例HD患者,随机分为稀释OL-HDF或继续低通量HD组,平均随访3年。结果显示,虽然两组间全因死亡率、心血管事件发生率无差异;但亚组分析却表明,随着置换量增加(<18.17L、18.18~21.95L和>21.95L),OL-HDF组的死亡率显著低于低通量HD组。
一项土耳其RCT(入组患者782例,随访2年)比较了OL-HDF与高通量HD,同样显示,虽然两组间主要终点(全因死亡率及非致命性心血管事件)及次要终点(心血管和总死亡率、透析并发症、住院率、实验室指标及药物使用的变化)无差异,但亚组分析却显示,置换量>17.4L时,OL-HDF组患者较高通量HD组患者的心血管(P=0.002)及总生存率(P=0.03)更佳,总死亡率下降46%(P=0.02),心血管风险下降71%(P=0.003)。
一项西班牙RCT研究比较了HD(8.1%为低通量HD,余为高通量)与高效OL-HDF(后稀释置换量>18L/次)的主要研究终点(全因死亡率)及次要终点(心血管死亡率、全因住院率、治疗耐受性及实验室指标)的差异。结果显示,OL-HDF组患者的全因死亡率降低30%(P=0.01)、心血管死亡率降低33%(P=0.06)、感染相关死亡率降低55%(P=0.03)。结论是,高效后稀释OL-HDF降低全因死亡率(上图)。
因此,近1年来连续发表的3项关于OL-HDF的RCT研究虽然在试验设计和结果上均存在一定差异,但基本都显示,OL-HDF的置换量达到一定程度后才能给患者带来获益,并由此提出了一个名词:高效HDF(high efficient HDF,后稀释置换量>17~18L)。
血液透析相关并发症
近来研究显示,血管钙化抑制因素的削弱也是血管钙化发生的重要原因,其中即包括维生素K的缺乏。2013年关于维生素K补充的一项RCT研究纳入HD患者200例,随机分为接受360、720或1080μg甲萘醌-7治疗,3次/周,持续8周。
结果显示,饮食维生素K2摄入与基质Gla蛋白质(MGP,血管钙化最强抑制剂)非活性状态有关(P=0.023),通过药物补充甲萘醌-7可剂量依赖性降低无活性MGP水平,但部分患者无法耐受药物气味而导致明显胃肠道反应。
此研究证实,维生素K2缺乏及药物补充对无活性MGP的影响,但仍须进一步研究来证实是否可通过此途径抑制及逆转心血管钙化。
钙化性尿毒症性小动脉病(CUA)是尿毒症患者的致死性并发症,目前无有效治疗。一项在北美进行的前瞻性研究观察了硫代硫酸钠(STS)的治疗效果。研究共纳入172例CUA接受STS治疗的患者,85%完成治疗,中位剂量为25g,治疗38次。
结果为,患者的最终完全缓解率为26.4%,极大改善率为18.9%,改善率为28.3%,无改善率为5.7%,治疗效果无记录率为20.8%;治疗患者一年死亡率为35%;患者无明显不良反应及实验室检查异常表现。
透析液成分相关研究
透析液的成分随着人们认知的改变而逐渐发生着变化,例如,透析液钙浓度经历了从低到高再到低的过程,这正是由于认识到高钙透析液带来的钙负荷及心血管钙化风险增加,目前越来越多的透析中心开始降低透析液钙。但须注意的是,透析液钙浓度降低亦可能带来一些风险。一项对510例心源性猝死HD患者的分析显示,低钙透析液(<1.25mmol/L)可能导致透析中血压下降。
透析液碳酸氢根浓度的问题也存在争议,过低无法充分纠正酸中毒,过高亦可能导致不良影响。透析预后与实践研究(DOPPS)纳入11个国家17031例接受3次/周透析的HD患者,分析发现,透析液碳酸氢根浓度与死亡率呈正相关;且透析年限越长,碳酸氢根浓度与死亡率间的关系越强。
醛固酮拮抗剂在血液透析患者中的应用
由于担心醛固酮拮抗剂可能带来的高钾风险,HD患者能否使用此类药物及该药物是否具有改善预后的作用尚不清楚。
针对这一问题,日本一项由5家医疗中心参加、随访3年的多中心RCT研究纳入了309例少尿HD患者,比较接受口服螺内酯(25mg/d,饮食钾摄入未作特别限制)与未接受口服螺内酯对心血管事件所致死亡或住院率(主要终点)及全因死亡率(次要终点)的影响。
结果显示,治疗组患者的主要终点事件发生率为5.7%,对照组为12.5%;治疗组患者的全因死亡率亦显著降低(6.4%对19.7%);主要副作用为男性乳房发育或乳房痛(10.2%),但严重高钾血症(1.9%)并不常见。因此,螺内酯可以用于HD患者并能改善预后。
血液透析的护理研究
在HD的护理方面,由于一种新型内瘘穿刺针――钝针的问世并在临床使用,引发人们对不同内瘘穿刺法即扣眼法与标准法的关注。
在一项RCT研究中,140例长期HD患者被随机分为接受上述两种穿刺方法,并随访观察17.2个月(标准法组)及19.2个月(扣眼法组),结果显示,两组患者的内瘘寿命相似[16.0个月(标准法组)对18.4个月(扣眼法组),P=0.2],内瘘血栓发生率亦无差异;但扣眼法组患者发生首次感染的中位时间为11.1个月,而标准法组则无患者感染,且在扣眼法组的70例患者中,有46例在中位时间为11.3个月后放弃扣眼法。因此,该研究并未发现扣眼法的优势。
但在另一项入组患者140例、随访1年的RCT研究中,则显示扣眼法组患者的1年内瘘生存率远高于标准组患者(100%对86%,P=0.005),且扣眼法组患者所需要干预更少(19%对39%)、内瘘动脉瘤扩大比例更低(23%对67%),且无感染发生,而标准法组发生2例感染。此项研究结果则显示了扣眼法的优势。目前还不清楚造成上述两项研究结果迥异的原因。
连续性肾脏替代治疗(CRRT)及相关技术
危重患者合并急性肾损伤(AKI)时的肾脏替代治疗剂量是个一直存在争议的问题。自几年前关于剂量的两个大型多中心前瞻随机对照研究(RCT,包括美国的ATN试验和大洋洲的RENAL试验)结果为阴性后,人们便开始期待欧洲IVOIRE研究的结果。
IVOIRE研究观察更高剂量[70ml/(kg?h)对35mg/(kg?h)]连续性静脉-静脉血液滤过(CVVH)对合并脓毒症及AKI患者的治疗作用。很遗憾的是,此项研究由于患者入选缓慢及缺乏进一步的相关支持而被提前终结。
该研究历时5年,欧洲18家重症监护病房(ICU)参与,纳入140例合并脓毒症休克及AKI的重症患者,CVVH治疗96h,主要终点为28天死亡率,共有137例患者完成研究。结果显示,两组患者28天死亡率无明显差异(高剂量37.9%对标准剂量40.8%,P=0.94)。次要终点比较亦无显著差异。
目前,越来越多的人认识到CRRT除对患者的治疗作用外,还可能存在对患者的不利影响,包括增加剂量带来的有用物质的丢失、抗生素的清除、高剂量相关的血管通路及液体管理的负荷增加。
因此,2013年学术界提出了CRRT创伤(CRRTtrauma)的概念,以引起人们对此类问题的重视。除剂量外,危重症患者合并AKI肾脏替代治疗的模式选择亦存在争议。
加拿大一项小型(纳入患者共78例)多中心RCT,比较了在小分子溶质清除率同为35ml/(kg?h)的情况下,CVVH与连续性静脉-静脉血液透析(CVVHD)的差异,结果显示,CVVH在短期内(1周)具有降低患者对血管活性药物需求量及改善序贯器官衰竭评估(SOFA)评分的趋势,但60天死亡率(CVVH:CVVHD=54%:55%)及存活者透析依赖率,二者间并无差异。
关于脓毒症患者血液净化治疗效果已有较多研究发表,但总的效果如何还并不清楚。最近发表的一篇相关荟萃分析显示,总的血液净化治疗干预降低死亡率(P<0.001;16项研究,n=827);但进一步分析显示,改善死亡率的研究主要来自于血液灌流及血浆置换的治疗,特别是来自日本关于多粘菌素B吸附治疗的结果,若将多粘菌素B的研究除外,则血液净化治疗无降低死亡率的作用(P=0.36;8项研究,n=457)。
肾移植后肾病复发的诊断与治疗
许多肾小球疾病会在肾移植后复发,包括局灶节段性肾小球硬化(FSGS)、IgA肾病、膜性肾病、膜增生性肾炎等,而肾移植术后肾病复发是引起移植肾失功的重要原因之一。
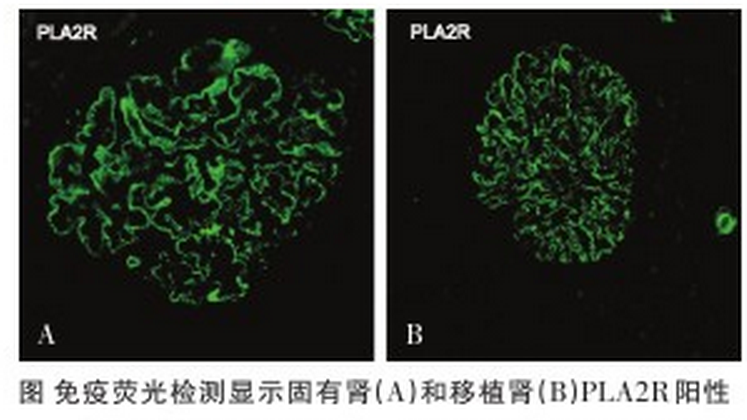
近年研究显示,特发性膜性肾病的发病机制与体内存在磷脂酶A2受体(PLA2R)抗体有关;肾移植后复发的膜性肾病同样与体内PLA2R抗体有关(上图),但肾移植后新发的膜性肾病则与PLA2R抗体滴度无关。
这提示,肾移植后新发膜性肾病的发生机制可能与PLA2R无关。有研究揭示,移植肾组织内PLA2R染色可区分膜性肾病为新发还是复发。
南京军区南京总医院全军肾脏病研究所最近进行的研究显示,肾移植后新发膜性肾病受者体内检测不到PLA2R抗体,移植图免疫荧光检测显示固有肾(A)和移植肾(B)PLA2R阳性肾组织足细胞PLA2R免疫组化染色阴性,而移植肾组织足细胞人类白细胞抗原(HLA)-DR染色阳性。
这提示,移植后新发膜性肾病可能与针对供者肾小球足细胞的同种异体免疫有关。这项假说有待进一步证实,若得到证实,这将是对移植后膜性肾病发生机制认识的重要进步,也将进一步完善传统的同种异体免疫理论。
肾移植后致密物沉积病(DDD)复发率接近100%,其发病机制与补体功能异常有关,很多移植中心将其列为肾移植相对禁忌证。最近有研究显示,DDD复发患者使用针对补体成分C5a的单克隆抗体依库珠单抗(eculizumab),可以缓解肾移植术后DDD复发患者的蛋白尿。这为移植后肾病复发患者提供了新的治疗思路。
肾移植术后单克隆IgG沉积增生性肾小球肾炎(PGNMID)术后复发较为常见,而应用抗CD20单克隆抗体治疗这类疾病可取得较好效果。
南京军区南京总医院全军肾脏病研究所最近进行了应用抗CD20单克隆抗体治疗肾移植术后单克隆免疫球蛋白沉积病的研究,结果显示,患者取得了较好的疗效,但远期疗效值得进一步观察。此外,还有应用蛋白酶抑制剂硼替佐米成功治疗肾移植术后膜增生性肾炎的个案报告。
补体依赖型HLA抗体、供者特异性抗体与肾移植存活率
晚期移植肾失功的主要原因是针对移植肾的抗体介导的排斥反应,而抗体检测技术的进步是帮助诊断此类疾病的重要工具。最近研究发现,无论是肾移植还是其他大器官移植,抗体介导针对移植物的免疫性损害在移植失败中发挥了重要的作用。
肾移植术后定期监测体内的抗体水平显得非常重要,如果出现针对供者特异性抗体(DSA),特别是新发的供者特异性抗体(de novo DSA),对移植肾的损伤作用更明显,需要及时予以干预,采用去除抗体治疗的方法可以提高移植肾远期存活率。有报告显示,硼替佐米可降低体内抗体水平,降低体液性排斥反应发生率,改善移植肾预后。
补体依赖性HLA抗体对移植肾的影响是新近的重要发现,研究显示,肾移植受者体内DSA和C1q阳性时,预后差;而单纯DSA阳性、C1q阴性者则与DSA阴性者的预后无差别。这提示,体内存在补体依赖性HLA抗体才会对移植肾造成损害。
有学者发现,当联合检测肾移植受者血液中的C1q和DSA时,若同时阳性,则诊断体液性排斥反应的敏感性和特异性均为100%。这为无创诊断和监测体液性排斥反应提供了全新手段,具广泛的临床应用前景。
根据此项研究,肾移植术后出现DSA不一定需要积极处理,在伴有C1q阳性时才要进一步处理,这些研究结论对肾移植后患者的远期管理,减少移植肾丢失,延长移植肾存活时间有重要影响。但其临床价值仍待进一步的观察和深入研究。
相关基础研究:miRNA与足细胞损伤
miRNA的表达与功能异常与一些肾脏疾病的发生密切相关。局灶节段性肾小球硬化(FSGS)是导致大量蛋白尿的一种常见病因,其中部分患者比较快地发展至终末期肾功能衰竭。miR-193a为抑癌基因,研究人员在研究其与肿瘤发生的作用时意外发现,miR-193a转基因小鼠经强力霉素诱导后很快出现FSGS,广泛的足细胞足突融合。
进一步研究发现,miR-193a可抑制WT1的表达,从而影响足细胞的分化,WT1表达水平的降低导致其靶基因PODXL、NPHS1及其他足细胞骨架结构蛋白表达的下调,从而引发整个足细胞稳定系统的破坏。
南京军区南京总医院全军肾脏病研究所从FSGS患者分离出的肾小球中,也检测到miR-193a的表达上调。miR-193a表达的上调可能是FSGS的新致病机制,可能成为一个潜在治疗靶点。
南京军区南京总医院全军肾脏病研究所的吴俊男等发现,miR-30s在足细胞中发挥了重要的保护作用。miR-30s在肾小球中特异性表达于足细胞,但在FSGS患者的肾小球中表达显著下降;体外试验证实,刺激因子诱导足细胞损伤后,miR-30s表达明显下降。
经miR-30a质粒转染的足细胞可有效抵御刺激因子所引起的足细胞损伤;相反,敲除足细胞miR-30s后,可观察到明显足细胞损伤。进一步研究还证实,miR-30s是通过抑制Notch1受体表达,阻断Notch信号通路活化发挥足细胞保护作用。
体外试验发现,损伤刺激后的足细胞的Notch1信号通路显著激活,这一表现在转染miR-30a质粒后的足细胞内被抑制。miR-30s还可以通过抑制p53表达有效保护足细胞。
此外,体内外试验还证实,糖皮质激素可以明显逆转氨基核苷嘌呤霉素(PAN)诱导的肾病综合征大鼠肾小球中miR-30s表达的下降。这提示,糖皮质激素可能通过调节miR-30s的表达,发挥肾脏和足细胞保护作用。
Sirt1可抑制足细胞Claudin-1表达,减轻糖尿病白蛋白尿
Sirt1是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的组蛋白脱乙酰酶,使受体蛋白脱已酰化。sirt1定位于细胞核内,除组蛋白外还以许多转录因子作为底物。该蛋白广泛存在于机体的各种体细胞及生殖细胞中,在肾皮质和髓质均表达。Sirt1的功能与基因沉默、机体长寿、衰老、能量代谢以及调控对应激的反应密切相关,并且在糖代谢和胰岛素的分泌中起重要作用。
长谷川(Hasegawa)等报告了Sirt1在糖尿病肾损伤中的重要作用。长谷川等发现,在链脲佐菌素诱导的糖尿病小鼠或db/db糖尿病小鼠模型中,在白蛋白尿出现前,近端小管中的Sirt1表达已经明显下调;Sirt1可通过去乙酰化机制活化Dnmt1,调节Cldn1基因的表达;通过足细胞中SIRT1介导的表观调节机制所致的Sirt1表达的下调和足细胞紧密连接蛋白Claudin-1表达的上调,减少白蛋白尿的发生。
这些结果表明,近端小管内的分子改变可诱导肾小球和足细胞的表型改变。长谷川等通过动物模型研究证实,近端小管特异的SIRT1转基因小鼠可预防糖尿病肾脏病变的发生,而近端小管特异性SIRT1敲除则可加重肾脏病变。这表明,近端小管中的SIRT1可影响肾小球功能。
来源:医学论坛报