【专家点评】多国学者共推《NELM处理建议》
发布时间:[2014.01.14] 点击:66次
既往认为胃肠胰神经内分泌肿瘤(GEP NEN或NET)较少见,但实际上其发病率在逐渐增加。“苹果之父”史蒂夫·乔布斯(Steve Jobs)即因罹患胰腺NET病故。65%~95%的GEP NET(阑尾、胃和直肠NET除外)在诊断时有肝转移,而肝转移是一个关键的预后因素,对NET肝转移(NELM)的处理缺乏基于证据的最佳实践策略,故其成为一个重要的临床问题。
针对NELM现有多种处理方法,从手术到各种介入消融手段,包括用多种细胞毒、生物或靶向药物进行局部和全身治疗。近期,由多国学者共同制定了一个《NELM处理建议》,发表于《柳叶刀·肿瘤学》杂志(Lancet Oncol 2014;15:e8)。该建议产生于一项国际共识会议,由欧洲-非洲肝胰胆协会(E-AHPBA)和7个国家或国际NELM相关学会组织,对现有NELM诊治策略进行回顾,由专家工作组针对15个特定问题作证据评估,再由独立的评委提供最终推荐意见,以指导临床实践和研究方向。以下本报结合该建议推荐内容,邀请第三军医大学西南医院的梁后杰教授进行相关点评。
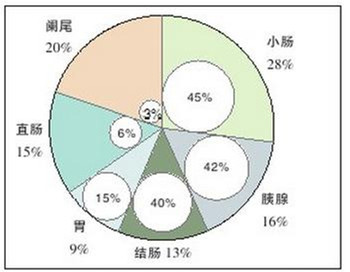
图1 GEPNET原发部位(扇形)和转移(圆圈)构成图,GEPNET最常见的原发部位是小肠,亦最常发生转移;直肠和阑尾较少发生转移
NELM临床实践推荐
NET的发病率、患病率及预后
NET的发病率约为1.9~5.7例/10万人一年,患病率约为35例/10万人;恶性NET和NELM的5年生存率分别约为37.6%~60.3%和56%。肝转移决定了恶性NET患者的预后(1级证据)。
NELM的诊断
Ki-67指数低的患者原发肿瘤灶切除后应该随访监测肝转移(≤25px或T1分化好的阑尾NET除外)(推荐强)(1级证据)。
目前证据不足以推荐基因签名和循环肿瘤细胞(CTC)用于预测肝转移和治疗决策。嗜铬粒蛋白A可用于检测肝转移和治疗后随访(推荐弱)(1级证据)。
磁共振成像(MRI)为确认NELM的最佳形态学成像方法;三维CT有助于评估肝内结构及对预期手术操作复杂的病例估测术后的残余肝体积;形态与功能联合成像可用于确定肝外转移(推荐弱)(1~2级证据)。
Ga-生长抑素受体正电子发射断层扫描(PET-CT)用于评估1~2级NET肝转移灶的可切除性;18F脱氧葡萄糖(FDG)PET-CT用于评估2级NET肝转移灶的可切除性(推荐弱)(1~3级证据)。
不推荐行多次活检评估Ki-67;如果肝转移灶的活检提供了全面的肿瘤相关信息,则不须行原发灶活检(推荐弱)(1级证据)。
NELM的治疗
肝切除 1或2级完全可切除的肝转移灶,且无可切除的肝外病变时肝切除应作为首选(推荐弱)(1~2级证据)。
在有不可切除性肝转移灶时是否应切除原发肿瘤 对胰腺NET,证据不足;小肠NET有局部淋巴结病变时可考虑切除(推荐弱)(1级证据)。
肝移植 应选择性地应用于NELM不可切除且无不可切除的肝外病变患者(推荐弱)(1级证据)。
新辅助与辅助治疗 对可切除的1~2级NET应用新辅助或辅助治疗证据不足(1级证据)。
局部消融方法 包括射频消融(RFA)、微波、激光消融等,应用于治疗不可切除性肝转移灶。可作为治疗的一种选择(推荐弱)(1级证据)。
经血管的肝脏定向性治疗 经动脉栓塞(TAE)、经动脉化学栓塞(TACE)以及选择性的内放射治疗(SIRT)应作为治疗方案中的一种选择(推荐弱)(1级证据)。
肽受体放射性核素治疗(PRRT) 应作为治疗中的一种选择(推荐弱)(1级证据)。
化疗、靶向或生物治疗 在姑息情况下,化疗、依维莫司和舒尼替尼可用于治疗胰腺NET;生长抑素类似物(SSA)应作为中肠NET(肝脏瘤荷低)治疗方案的一部分(推荐强)(1~4级证据)。
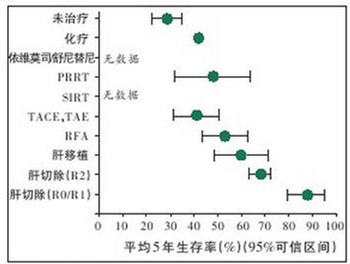
图2 NELM不同治疗方法的5年生存率(PRRT:肽受体放射性核素治疗;SIRT:选择性的内放射治疗;TACE:经动脉化学栓塞;TAE:经动脉栓塞;RFA:射频消融)
NELM临床和基础研究建议
需要有纳入标准明确的NET国际注册数据。
改进Ki-67指数,对增殖在分子水平再定义。确定每一级别中不同生物学行为的亚组。嗜铬粒蛋白A的检测应标准化。进行临床试验评估基于血液的分子签名和CTC的应用价值。从生物标本库中确定与预后和治疗反应相关的分子生物标志物。进行前瞻性研究评价联合形态学和功能学成像方法评估肝转移灶可切除性的价值。确定疾病进展和治疗反应的新标准。进行不同治疗方法间的临床对照研究以获得更充分的患者选择和疗效证据。
专家点评
第三军医大学西南医院梁后杰、赵晓昕:肝转移是GEPNET最易出现的远处转移,也是影响预后的最关键因素。此次国际工作组制定了《NELM处理建议》(以下简称《建议》),针对15个关键问题给出了推荐意见。鉴于不同来源的NET分子基础和生物学特性不同,且目前尚缺乏高级别的循证医学证据,因此,在临床实践中,尚需要结合我国实际,对治疗方法和治疗时机做出合理选择。
手术切除是唯一可能达到治愈的治疗方法,因此《建议》推荐对1~2级完全可切除的NELM,且无不可切除的肝外疾病者首选肝切除术。但对不能完全切除的1或2级NELM,是否行减瘤手术?单发或可切除的3级NET是否行手术切除?对此类患者尚无生存获益的证据,在临床实践中建议由专业诊治中心多学科团队进行评估。由于缺乏高级别循证证据,本《建议》不推荐对可切除的1~2级NET进行辅助治疗。目前资料显示,肝切除术后5年生存率为46%~86%。但仅20%~57%的患者可完全切除,术后5年有94%的患者出现局部复发。因此,要想进一步降低术后复发率,延长生存期,在临床实践中应充分评估复发风险,寻找预测复发的有效指标,确定需要进行辅助治疗的人群和有效手段。
对于不可切除的NELM,通过RFA、激光消融、TAE、TACE和SIRT等局部治疗手段,可有效减轻肿瘤负荷、减少激素分泌,改善生活质量。TAE、TACE和RFA可使肝转移灶<125px且无肝外转移的患者获益,但目前针对肝转移灶的局部治疗仅有小样本回顾性研究,适应证及治疗时机还不明确。我国医师可根据临床经验在实践中将局部治疗与全身治疗联合应用。
NELM全身治疗方法包括化疗、分子靶向和生物治疗等。根据现有证据,《建议》推荐,化疗、依维莫司和舒尼替尼用于胰腺NET的姑息治疗,SSA可作为中肠NET治疗选择。在临床实践中,选用何种治疗方法,主要取决于肿瘤负荷、分级和增殖状态。对于肿瘤负荷较小,侵袭性弱的NET建议采用SSA治疗;对于肿瘤负荷较大,侵袭性强的肿瘤建议首选化疗;对于不适合化疗或者局部治疗患者,分子靶向治疗可作为首选。
鉴于不同部位来源的NET生物学特性各异,对药物的反应不同,目前尚不明确最佳治疗顺序。肿瘤分子靶点存在较大异质性,尚缺乏预测疗效的分子指标。分子靶向药物与化疗或生物治疗的联合应用还有待于进一步研究。
来源:中国医学论坛报