造影增强内镜超声对胰腺病变定量分析价值的初步探讨
发布时间:[2011.03.24] 点击:1383次
EUS已是消化内镜领域中成熟的,同时也是最为准确的影像诊断技术之一。但是对于后腹膜的胰腺,除囊性病灶外,胰腺占位一般均表现为均匀或不均匀的低回声病灶,单纯凭借常规EUS影像对病灶性质鉴别仍存在很大局限[1]。超声造影剂能使多普勒血流信号明显增强,提高病灶内微血管信号的显示能力,使常规超声检查不能显示的血管分布如肿瘤病灶内部血流的异常灌注区得以清晰显示。我们曾对18例不同胰腺病变及5例正常胰腺进行造影增强EUS检查,将造影增强特点分为不同的增强模式、增强时相及增强强度,结果发现正常胰腺、慢性胰腺炎及不同的胰腺良恶性占位病变均显示出不同的EUS超声造影增强特征[2]。但是多数情况下对超声造影图像的诊断仍为定性判断,很大程度上会受到主观因素的影响。为了更深一步的研究,我们尝试应用造影分析软件将造影增强后的参数系统量化,拟求获得更为客观可信的结论。
资料与方法
一、一般资料
2008年7月至2009年12月在我院经多种影像学检查包括腹部B超、CT、MRI等发现或疑有胰腺占位及慢性胰腺炎患者32例,同时因其他上消化道原因行超声内镜检查的胰腺正常患者19例,共5l例纳入研究,其中男36例,女15例,年龄25—79岁,平均57.02岁。所有患者事先均签署知情同意书。
胰腺局部占位性病变26例,常规EUS提示胰腺局部占位,并且在完成造影增强内镜超声检查后于病灶处行内镜超声引导下穿刺(EUS—FNA),最终的诊断由细胞学、组织病理或外科手术证实。
慢性胰腺炎6例,患者有慢性腹痛、脂肪泻等临床症状和(或)急性胰腺炎反复发作的病史,腹部B超及CT符合慢性胰腺炎诊断,常规EUS排除胰腺占位性病灶,且提示有下列1或2项特征性改变:胰腺实质内有高回声光点(钙化),伴小叶状分隔(纤维化)的胰腺实质非均质改变;胰管呈不规则扩张或狭窄,管壁回声增强,部分可见侧枝胰管的扩张。
正常胰腺19例,患者因其他上消化道原因进行超声内镜检查,排除胰腺疾病的相关病史(如消化不良、酒精滥用或是胰酶升高等),腹部B超、CT及常规超声内镜均未发现病理性改变。
二、器械与方法
1.器械:超声仪器采用日本Fujinon公司SU7000电子超声内镜系统,EG-530UR环扫型超声内镜,EG-530UT电子凸面线阵超声内镜,探头频率5—12 MHz。
2.超声造影剂及使用:超声造影剂采用六氟化硫(SonoVue@,意大利Bracco公司),剂量为25 mg冻干粉,用灭菌生理盐水5 Illl配置成5 g/L的浓度。注射前用力晃动20 s后使之形成微泡悬浮液,以团注方式注射入腕或肘部浅静脉,继以生理盐水5 111l冲管。
3.EUS探查:先行常规EUS检查,观察胰腺病变的部位、大小、边界、回声,找见目标病灶或区域后调整超声功率至低机械指数(MI=0.4),调定流速范围至±9.6 cm/s~-4-14.4 cm/s,并调整其多普勒信号强度至彩色血流信号无溢出。注射超声增强剂后对EUS彩色多普勒图像进行全程录像,持续90 s,直至增强效应基本消失,以备结果分析。随后行EUS—FNA。
4.WTECH超声造影定量分析系统:该分析系统由上海申维影像科技有限公司开发,符合DICOM3.0国际标准,具有感兴趣区域(ROI)的颜色对应功能:对每一个感兴趣区域给出唯一对应的颜色;具有ROI强度计算功能:对视频动态造影图像进行分析并能够给出ROI平均强度值;具有时间强度曲线及弹丸注射的回归分析曲线生成功能:生成造影随时间变化的造影平均强度曲线(TIC曲线),给出产生显影的时间(AT)、达到峰值强度的时间(T11P)及峰值强度(PI)等数据。
三、观察指标
1.AT、7rrP:在胰腺占位性病变中,分别选定肿块及其周围部分正常胰腺实质为ROI行TIC曲线分析,比较两者AT值,若肿块AT值>周围胰腺实质AT值,则判定肿块为慢进型,反之则为快进型;比较两者的TTP值,若肿块的TTP值>周围胰腺实质的TTP值,则判定肿块为慢出型,反之则为快出型:根据AT值与TTP值的比较可以确定肿块的增强时相特点。
2.PI值:在胰腺占位性病变中,选定肿块为ROI行TIC曲线分析时,记录肿块的PI值,确定其增强强度;在正常胰腺和慢性胰腺炎中,选定探查范围内胰腺实质为ROI并行TIC曲线分析,记录胰腺实质的PI值,确定其增强强度。
四、统计方法
数据采用SPSS 13.0统计软件进行分析,在胰腺占位性病变中,采用配对t检验法比较病灶与周围正常胰腺之间PI值的差异;采用成组f检验法分别比较正常胰腺与慢性胰腺炎、胰腺癌、胰腺内分泌肿瘤之间PI值的差异以及胰腺癌与胰腺内分泌肿瘤之间PI值的差异;由于胰腺囊性病灶的PI值不符合正态分布,所以胰腺囊性病灶与正常胰腺、胰腺癌及胰腺内分泌肿瘤之间PI值的差异比较采用Wilcoxon法。以P<0.05为差异有统计学意义。
结 果
所有患者均成功进行了造影增强EUS检查并获得可用于结果分析的清晰图像,以超声内镜引导下细针穿刺细胞学、组织病理学结果或手术病理结果为最终诊断。该研究中所有可疑胰腺占位及慢性胰腺炎患者均获得了最终确诊,其中胰腺癌14例,胰腺内分泌肿瘤4例,胰腺囊性占位8例,慢性胰腺炎6例,正常胰腺19例。
一、定量分析曲线。
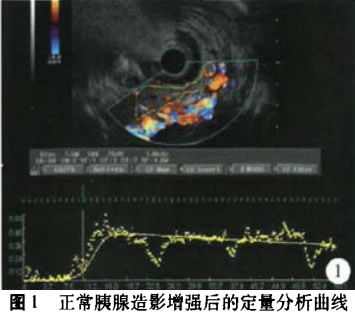
1.正常胰腺:19例正常胰腺行SonoVue造影增强EUS后定量分析,记录19例正常胰腺的PI值并进行分析。(图1)。
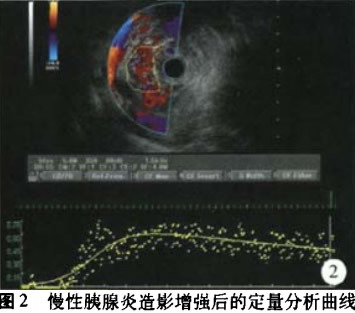
2.慢性胰腺炎:6例慢性胰腺炎行SonoVue造影增强EUS后定量分析,记录6例病人的PI值并进行分析。(图2)。
3.胰腺局灶性占位。
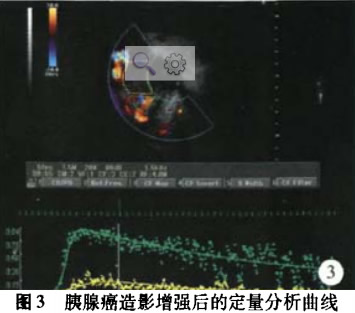
(1)胰腺癌:其中胰头5例,胰体6例,胰尾3例。14例胰腺癌病人行SonoVue造影增强EUS后,对所得图像进行定量分析,显示11例(78.6%)病灶的AT值大于周围正常胰腺实质的AT值,而11甲值小于周围正常胰腺的哪值,即为慢进快出的增强时相;另外3例病灶的AT值小于周围正常胰腺实质的AT值,而TTP值小于周围正常胰腺的1TrP值,即为快进快出的增强时相。同时记录14例病人的PI值并进行分析。(图3)
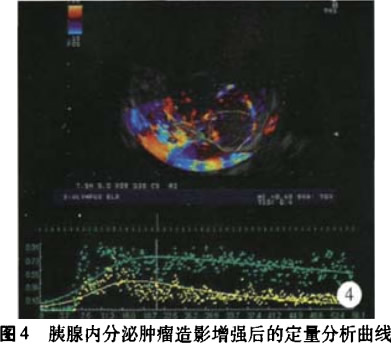
(2)胰腺内分泌肿瘤:其中胰头l例,胰颈2例,胰尾l例。4例胰腺内分泌肿瘤行SonoVue造影增强EUS后,经定量分析显示所有病灶的AT值均小于周围正常胰腺实质的AT值,并且所有病灶的,ITI’P值也均小于周围正常胰腺的rrllP值,即为快进快出的增强时相。同时记录4例病人的PI值并进行分析。(图4)
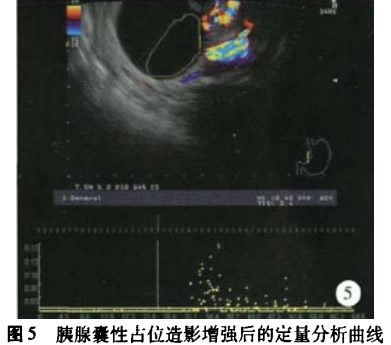
(3)胰腺囊性占位:3例假性囊肿、2例浆液性囊腺瘤、l例黏液性囊腺瘤、1例副脾囊肿和l例导管内乳头状黏液瘤行SonoVue造影增强超声内镜后,经定量分析显示所得TIC曲线均为一直线。同时记录所有病灶的PI值并进行分析。(图5)
二、PI值及其统计分析结果1.所有病例经过SonoVue造影增强超声内镜后,经定量分析均记录了PI值。见表1
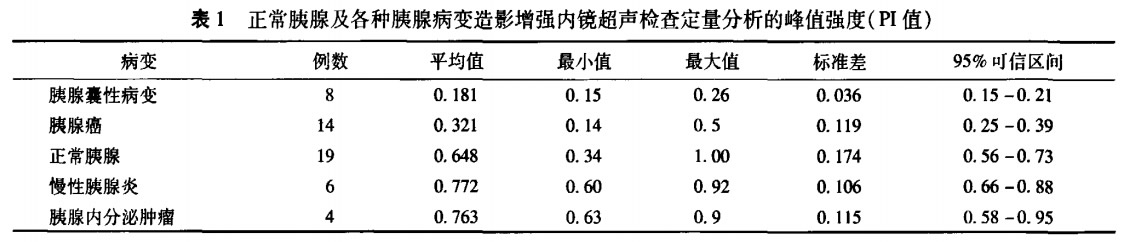
2.在胰腺占位性病灶中分别比较了病灶与周围正常胰腺实质之间的PI值,在胰腺癌与胰腺囊性占位中,病灶与周围正常胰腺实质之间Pl值的差异有统计学意义(P<0.01)。而在胰腺内分泌肿瘤中,病灶与周围正常胰腺实质之间PI的差异无统计学意义(P>0.05)。
3.将正常胰腺实质的Pl值分别与胰腺癌、胰腺内分泌肿瘤、慢性胰腺炎、胰腺囊性病灶的PI值进行比较,认为正常胰腺实质与胰腺癌病灶及胰腺囊性病灶之间PI值的差异均具有统计学意义(P<0.01,P<0.05),而正常胰腺实质与胰腺内分泌肿瘤及慢性胰腺炎之间PI值的差异无统计学意义(P>0.05)。
4.在胰腺占位性病灶中分别比较胰腺癌与胰腺内分泌肿瘤及胰腺囊性病灶之间的PI值,认为胰腺癌与后两者之间的Pl值差异均具统计学意义(P<0.01,P<0.05)。
5.分别构建胰腺囊性病灶与胰腺癌,胰腺癌与正常胰腺之间PI值的ROC曲线,评价其诊断价值。根据ROC曲线所见,胰腺囊性病灶与胰腺癌之间的曲线下面积为0.839,(95%CI:0.660一1.019,P<0.01),其最佳诊断临界值为0.195,诊断敏感度、特异度分别为85.7%、87.5%;胰腺癌与正常胰腺之间曲线下面积0.955,(95%CI:0.891—1.018,P<0.01),其最佳诊断临界值为0.505,诊断敏感度、特异度分别为100.0%、84.2%。由于其他病变之间ROC曲线下面积均小于0.5,所以无显著诊断价值。
讨 论
由于胰腺为一乏血供脏器,常规EUS下的多普勒血流模式并不能显示其实质性占位内部的微血流灌注,而超声造影剂的应用则可使胰腺不同的病变呈现不同的增强时相、强度等,由此EUS下的超声造影检查对胰腺肿块的良恶性鉴别以及慢性胰腺炎的判断得到了很大提高[3]。
我们前期曾对18例不同胰腺病变及5例正常胰腺进行SonoVue造影增强EUS定性检查,将造影增强特点分为不同的增强模式、增强时相及增强强度,结果发现造影增强后5例正常胰腺实质旱均匀分布的点状或棒状血流信号,且大部分呈2级增强(25%≤增强面积<50%);而2例慢性胰腺炎患者的胰腺实质呈棒状或斑块状彩色血流信号,且分布不均匀,呈3~4级增强(增强面积/>50%);13例胰腺癌病变内部均呈少量点状或棒状增强,且大部分呈慢进快退型,均呈1级增强(增强面积<25%);3例胰岛细胞瘤病灶内部呈整体斑块状增强,且呈快进快退型,呈3~4级增强(增强面积≥50%)[2]。我们的初步结论提示,造影增强EUS检查使各种胰腺良、恶性占位病变及慢性胰腺炎呈现不同于正常胰腺实质的血流灌注特征,有助于胰腺肿块的性质鉴别。国外也已有相关的报道证实超声内镜下造影增强对胰腺疾病的诊断是有价值的[1,4-6]。Saftoiu等[7]对12例慢性胰腺炎和20例胰腺癌通过软件计算感兴趣区域的能量多普勒血流指数,其良恶性病灶的鉴别敏感度、特异度、准确率、阳性预测值和阴性预测值分别可达到90.5%、90.1%、90.6%、95.0%、83.3%。
本次研究中,我们将造影增强后的记录图像通过软件后处理分析,将造影增强的相关参数定量化。正常胰腺的PI值为0.648±0.174,通过与其余胰腺病变PI值的比较,发现其与胰腺癌和胰腺囊性病灶的PI值之间的差异具统计学意义,且通过ROC曲线得出正常胰腺与胰腺癌之间PI值的最佳诊断临界值为0.505,敏感度、特异度分别为100.0%、84.2%;而正常胰腺实质与胰腺内分泌肿瘤及慢性胰腺炎之间PI值的差异无统计学意义,但从PI值的分布图中,我们发现它们之间还是有差异趋势的,由于后两者样本量较小,它们之间PI值的差异还有待更多病例数的研究。6例慢f生胰腺炎中PI值较大,为0.772±0.106,这种造影增强特征可能与慢性胰腺炎患者的胰腺实质血供较正常胰腺丰富且可伴有不均分布的纤维组织增生及淋巴细胞浸润有关。
在胰腺占位性病灶中,分别比较了病灶与周围正常胰腺实质之间的PI值,在胰腺癌与胰腺囊性占位中,病灶与周围正常胰腺实质之间PI值的差异有统计学意义;而在胰腺内分泌肿瘤中,病灶与周围正常胰腺实质之间PI值的差异无统计学意义,这也可能与胰腺内分泌肿瘤的样本数较少有关。胰腺癌与胰腺囊性病灶及胰腺内分泌肿瘤之间PI值的差异是有统计学意义,且通过ROC曲线得出胰腺癌与胰腺囊性病灶之间PI值的最佳诊断临界值为0.195,敏感度、特异度分别为85.7%、87.5%。14例胰腺癌中,通过病灶内部和周围正常胰腺实质的AT、m值的比较,显示78.6%胰腺癌病灶为慢进快出型,说明肿块内部血流的灌注较慢而消退较快,我们认为这可能是由于胰腺恶性肿瘤中血管被肿瘤组织侵犯,血管紊乱易形成动静脉短路有关。同时其PI值在胰腺占位性病灶中相对较小,为0.321±0.119,这可能与胰腺本来相对血供较差,而胰腺恶性肿瘤内出现的不同程度坏死、液化也会影响到病灶内的血流灌注情况。4例胰腺内分泌肿瘤中,通过病灶内部和周围正常胰腺实质的AT、TTP值的比较,均显示为快进快出型,说明肿块内部血流的灌注较快并且消退也较快。其PI值在胰腺占位性病灶中相对较大,为0.763±0.115,这可能与其间质有丰富的血窦,血供比周围胰腺实质更加丰富有关。这也与国外Kitano等[8]、Hocke等旧1报道的结果一致,即87.5%的胰腺内分泌肿瘤表现出明显增强的造影模式。8例各种性质的胰腺囊性病变的PI值明显偏小,为o.181±0.036,且内部无血流信号强弱变化趋势,TIC曲线均为一直线。这提示造影增强虽能够使我们对于囊性病灶内部的血流信号进行判别,但目前尚不能体现对胰腺囊性病变具体性质的鉴别价值。
EUS能提供清晰的胰腺图像,但目前单纯凭借其影像对胰腺不同良恶性病变的鉴别仍然存在相当的局限,而结合超声造影剂的应用,使得超声增强EUS在EUS.FNA之前即获取病灶性质的判断,为EUS的影像诊断又增添了一种新的手段。我们在对EUS造影增强影像进行定性分析的基础上,应用专用软件对造影增强的特征进行定量分析,发现相关定量参数在正常胰腺、慢性胰腺炎及胰腺良恶性占位之间存在有效的差异,这也使得判断的结果更加客观可信。当然造影增强EUS的检查过程中仍有一些因素会影响判断的结果,如呼吸运动、消化道蠕动等。此外胰腺实质不同部位的血流灌注之间是否存在差异,这些均有待更多相关资料的分析。
参考文献
[1]Kahl S,Schfitte K。Malfertheiner P.Pancreatic cancer.En—dosonography.Chinese—German J Clin Oncol。2007.6:123—128。
[2]诸琦,熊慧芳,徐凯,等.造影增强超声内镜检查对胰腺占位病变的鉴别诊断初步探讨.中华消化内镜杂志,2008,25:
126.130。
[3]Hocke M,Schulze E,Gottschalk P,et a1.Contrast—enhancedendoscopic ultrasound in discrimination between focal pancreatitisand pancreatic cancer.World J Gastroenterol,2006,12:246-250.[4]Becker D,Strobel D,Bematik T,et a1.Echo.enhanced color-and power-Doppler EUS for the discrimination between focal pan—creatitis and pancreatic carcinonla.Gastrointest Endoae,2001,53:784-789。
[5]Giovannini M.Endosonography:new developments in 2006.Sci—entificWoddJournal.2007。7:341-363。
[6]Rickes S,Unkrodt K,Neye H,et a1.Differentiation ofpanereat—ic tumours by conventional ultrasound,unenhanced and echo-en.hanced power Doppler sonography.Scand J Gastreenteml,2002,37:1313—1320。
[7]Saftoiu A,Iordache S,Gheonea D,et a1.Contrast-enhancedpower Doppler endoscopic ultrasound used for the differential di-agn06is of chronic pancreatitis and pancreatic CanCe.GaatrointestEndosc,2009,69:AB332。
[8]Kitano M,Kudo M,Maekawa K,et a1.Dynmic im丑gi-S ofpan-creatic diseases by contrast enhanced coded phase inversion hat-monic ultrasonography.Gut,2004,53:854-859。